結局MRI認定の記事です。
認定試験が終わり、合否が出たばかりでしょうから受かった方も落ちた方もなかなかモチベーションが上げられないとは思います。
そんな中のMRIの記事。
いつも皆さんの需要には答えられていないと思いますが僕はあまり空気が読めませんので関係なく投稿させていただきます。
今回も全然おもしろくはありませんし法令の話なので読むのはちょっとしんどいと思います。
その代わりなるべく大事な要点のピックアップと説明を付け加えていきます。
過去には第15回に1問だけ出題されたことのあるもので今後も出そうな予感です。
では、くどいタイトルの記事ですがはじめます。
植込み型医療機器等のMR安全性にかかる対応について
令和元年 8 月 1 日付で厚生労働省の医薬・生活衛生局から発令されました。
1.MR検査に関する安全性評価の実施について
医療機器を製造販売する場合についての項目となります。
(1) 金属が含まれる植込み型医療機器等の製造販売業者は、原則、ASTM又はISOに基づくMR検査に関する安全性評価を行うこと。
安全性評価は磁気変位力、トルク、発熱が挙げられます。
※金属が含まれる植込み型医療機器等:患者の体内又は体外に一時留置する医療機器で、留置したままMR検査を行い、当該医療機器がMR装置のガントリー内に入る蓋然性が高いものを含む。
上記は体内に留置した非金属ドレーンの体外部分に金属を使用したものが考えられます。蓋然性が高いとは可能性が高いということです。また、通常MR 検査時に取り外すものは蓋然性が低いと言えます。
(2) 本通知発出日から3年を経過した日以降に、次に掲げる植込み型医療機器等のうち金属を含むものを新たに製造販売承認申請する際には、当該医療機器等にかかるMR検査に関する安全性評価の結果を申請時に添付すること。なお、申請者自らMRに関する安全性を評価して製造販売承認申請時に添付することは差し支えない。
・新医療機器
・クラスIVの医療機器
・クラスIIIの能動型医療機器
要約するとこれらに金属を含んでいれば製造販売申請時に安全評価の結果を添付しなければいけません。
クラス分類についてですが、医療機器の不具合発生時における生体に対するリスク度合いに応じて4つのクラスに分類しています。
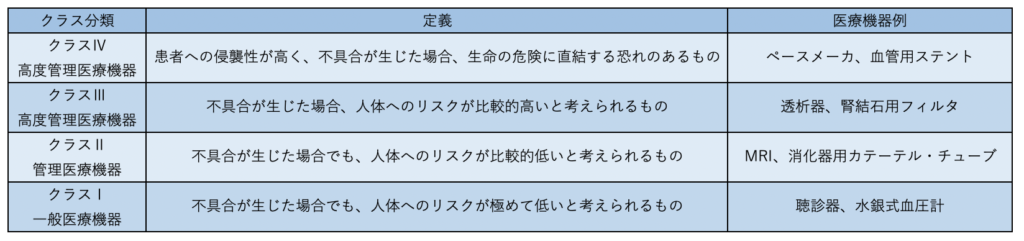
通知から3年(令和3年8月)は経過しているので今後は適用されますね。
2.添付文書における安全性評価に関する情報提供の方法について
金属が含まれる植込み型医療機器等の添付文書には、原則として、以下の(1)から(5)のいずれかを記載すること。
(1) ASTMやISOの試験規格等の試験によりMR検査に関する安全性評価を実施していない場合、【使用上の注意】の[重要な基本的注意]の項に以下の内容を記載すること。
本品については、試験によるMR安全性評価を実施していない。
(2) 対象医療機器をMR Safe とする場合、【使用上の注意】の[重要な基本的注意]の項に以下の内容を記載すること。
本品はMR Safe であり、一般的なMR検査による影響はない。
(3) 対象医療機器をMR Unsafe とする場合、【禁忌・禁止】の項に以下の内容を記載し た上で、【使用上の注意】の[相互作用]の項に、「併用禁忌(併用しないこと)」 に「磁気共鳴画像診断装置(MRI 装置)」を記載すること。
本品はMR Unsafe であり、MR検査は禁忌とする。
(4) 対象医療機器をMR Conditionalとするため、ASTMの試験規格に基づくMR 安全性評価を実施した場合、以下の記載例を参考にして、MR検査を実施可能な撮像条件等 を【使用上の注意】の[重要な基本的注意]の項に記載すること。

(5)ISO等の ASTM 以外の試験規格等によりMR検査に関する安全性評価を実施した場合、(4)の記載例を参考にして、MR 検査を実施可能な撮像条件等を【使用上の注意】 の[重要な基本的注意]の項に記載すること。ただし、能動型医療機器でMR適合性評価を行った場合は、承認書の「使用方法」 に撮像条件が特定されている場合には、【使用方法等】に撮像条件を記載し、温度上昇に関する情報は、【使用上の注意】の「重要な基本的注意」の項に記載すること。
ここの項目では添付文書に記載しなければならない内容についてとなります。
(1)は安全評価をしていなければ「していません」と書けよ。
(2)(3)はMR Safeなら「MR SafeなのでMRI大丈夫」と、MR Unsafeなら「MR UnsafeなのでMRI禁忌」と書けよ。
(4)はMR Conditionalのときは「撮像条件」を書けよと言っております。
ごちゃごちゃしておりますが(4)ではASTMに則って安全評価をした場合、(5)はASTM以外の試験規格で安全評価した場合となります。
ざっくりな説明ですのでちゃんと勉強するのであれば発令された文章を覚えてくださいね。
3.既承認品等の取り扱い
(1) 1.(1)及び2.に示す事項に関して、本通知発出時に既に製造販売承認、製造販売認証又は製造販売届出されている医療機器のうち、クラスIV及びクラスIIIの医療機器については本通知発出日から3年以内に、クラスII及びクラスIの医療機器については 本通知発出の日から5年以内に対応すること。
既に承認を受けているものもクラスⅣ、Ⅲは発令から3年以内(令和3年8月まで)、クラスⅡ、Ⅰは5年以内(令和5年8月まで)に対応しなければいけません。
(2)クラスIV及びクラスIIIの能動型医療機器については、承認事項一部変更申請時にMR検査に関する安全性評価の妥当性を確認することとするが、承認事項一部変更申請 が承認されるまでの間は、MR検査に関する安全性評価は自己評価によるものであるため、上記2.の記載をする場合、「自己認証による」と併せて記載すること。また、 1(1)に規定される金属が含まれる植込み型医療機器等のうち、1(2)に示されて いる医療機器を除いた医療機器についても、MR検査に関する安全性評価は自己評価に よるものであるため、「自己認証による」と併せて記載すること。
既に承認を受けているもので変更申請が承認されるまでは安全評価は「自己認証による」と記載しなければなりません。ということだと思います。
(3)添付文書改訂において不明な点については、独立行政法人医薬品医療機器総合機構医療機器品質管理・安全対策部医療機器安全課に相談されたい。
この記事は「あまり信じられないので正確に知りたい」という場合は上記に相談してください。ということです。
以上となります。
過去問からの出題
第15回-47
第15回-47
令和元年 8 月 1 日付で厚生労働省医薬・生活衛生局から発令された「植込み型医療機器等の MR 安全性にかかる 対応について」に関する正しい記述はどれか。2つ選べ。
- ASTM や ISO に基づく MR 検査に関する安全性評価をしていない植込み型医療機器を販売してはならない。
- MR Conditional とするため ASTM の試験規格に基づく MR 安全性評価を実施した場合は B1+rms の値を記載する。
- ISO 等の ASTM 以外の試験規格により MR 検査に関する安全性評価をした場合は別に厚生労働省に審査申請を行う。
- MR Safe とする場合は【使用上の注意】の[重要な基本的注意]の項に「一般的な MR 検査による影響はない」と記載する。
- MR Unsafe とする場合は【禁忌・禁止】の項に「MRI 検査は禁忌とする」と記載のうえ MRI 装置が併用禁忌であることも記載する。
1.×原則MR検査に関する安全性評価を行うこととなっているが、行なっていない場合「本品については、試験によるMR安全性評価を実施していない。」と記載する
2.×
3.×MR検査を実施可能な撮像条件等を『使用上の注意』の『重要な基本的注意』の項に記載する
4.○
5.○
まとめ
認定試験の対策としてはMR Conditionalの撮像条件にどのようなことを記載するかチェックしておけばいいかと思います。
記載例を見るに、①静磁場強度、②静磁場強度の勾配、③SAR、④スキャン時間あたりの温度上昇、⑤アーチファクトなどかと
久々にゴロです。
*セイジさん、高速のSA(サービスエリア)で温度上昇してアチッ*
静磁場強度 勾配 SAR 温度上昇 アーチファクト
セイジさんは昔お世話になった人です。
次の認定試験まではまだまだありますが少しずつでも覚えていけるといいですね。











コメント